9月7日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室郭瑞庭教授团队与清华大学药学院张永辉教授团队合作,在国际重要学术期刊Nature上发表了题为“Phosphoantigens glue butyrophilin 3A1 and 2A1 to activate Vγ9Vδ2 T cells”(膦抗原交联嗜乳脂蛋白3A1和2A1激活Vγ9Vδ2 T细胞)的研究论文(图1)。张永辉教授和郭瑞庭教授为通讯作者,清华大学博士生袁琳洁、马先强以及湖北大学杨云云副教授为共同第一作者。

图1.γδT细胞免疫识别机制
根据T细胞受体的不同,T细胞可分成αβ T细胞和γδ T细胞。αβ T细胞通过识别MHC分子呈递的肽类抗原来识别肿瘤细胞,而γδ T细胞不同于αβ T细胞,能够特异性识别肿瘤细胞异常代谢产生的内源性膦抗原,以及病原体感染产生的外源性膦抗原,对病原体和肿瘤发挥重要的免疫监视功能。2019年,张永辉团队与郭瑞庭团队首次合作,发现膦抗原通过结合到BTN3A1胞内域,诱导胞外域构象改变,从而激活Vγ9Vδ2 T细胞。
此外,早期研究表明,仅BTN3A1的存在不足以介导膦抗原激活Vγ9Vδ2 T细胞,为了寻找和BTN3A1协同作用的伴侣分子,研究团队首先发现BTN2A1蛋白在膦抗原激活Vγ9Vδ2 T细胞中起着关键的作用,并通过结构生物学、生物化学等手段详细展示了膦抗原如何像“分子胶水”一样,促进BTN3A1与BTN2A1蛋白胞内域的紧密结合(图2)。
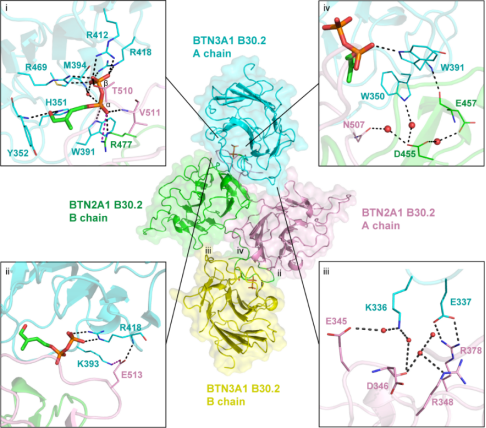
图2.膦抗原HMBPP作为分子胶水促进BTN3A1和BTN2A1胞内域的紧密结合(i)膦抗原HMBPP与BTN3A1和BTN2A1胞内域的相互作用网络;(ii-iv)BTN3A1和BTN2A1胞内域的相互作用网络。
膦抗原促使异源BTN3A1与BTN2A1胞内域结合后,信号是如何从内部传导至外部,以供gdT细胞受体感知呢?为了深入解析这一分子机制,研究团队采用了一系列免疫学、结构生物学、分子动力学模拟和分子探针等实验手段,发现BTN3A1与BTN2A1蛋白胞内域结合后,诱导了BTN3A1与BTN2A1胞外域表位的暴露,从而有效地与Vγ9Vδ2 T细胞受体结合,最终实现对gdT细胞的激活(图3)。对膦抗原结合BTN3A1与BTN2A1蛋白激活Vγ9Vδ2 T细胞分子机制的研究,有助于开发更有效的基于Vγ9Vδ2 T细胞进行病原体感染和肿瘤免疫治疗的方法。

图3.膦抗原交联BTN3A1和BTN2A1胞内域后,诱导胞外域的表位暴露,从而有效地与TCR结合
郭瑞庭教授研究团队长期从事生物降解酶、萜类合成酶、抗肿瘤新靶点的结构解析与机理研究,在Nature Catalysis、Nature Reviews Chemistry、Immunity、Angewandte Chemie International Edition、JACS、ACS Catalysis、Nature Communications等国际期刊上发表150余篇高水平论文。团队成员杨云云副教授长期从事抗肿瘤新靶点的结构解析和抗肿瘤天然产物生物合成过程中的酶促反应机制等研究,在Immunity、Angewandte Chemie International Edition、ACS Catalysis等国际期刊上发表多篇SCI文章。该研究工作得到了国家自然科学基金、湖北洪山实验室重大项目以及省部共建生物催化与酶工程国家重点实验室开放课题等项目的支持。
论文连接:https://www.nature.com/articles/s41586-023-06525-3
(审稿:谢玉平)