3月24日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室李壮课题组在《Cell Research》发表题为《Target DNA-induced filament formation and nuclease activation of SPARDA complex》的研究论文。博士生王凤和硕士生徐海江为共同第一作者,李壮副教授为通讯作者。

图1 文章首页
短原核Argonaute是细菌免疫体系中的重要组成部分,可以通过自身结合的单链核酸来感知入侵移动遗传元件的靶核酸,并通过激活效应蛋白的活性,来实现细菌免疫。同时,依靠TIR/SIR2的NADase活性以及DREN的核酸旁切活性,可以实现体外的核酸检测应用。短原核Argonaute包括SPARTA、SPARSA、SPARDA等系统。目前关于SPARTA和SPARSA系统有相对清晰的机制研究,但尚未有关于SPARDA的机制研究。
李壮团队通过一系列生化实验发现,SPARDA复合物形成高聚体的比例及SPARDA复合物的切割活性与靶DNA的长度呈正相关。随后的结构生物学研究发现,SPARDA被靶DNA激活的过程中,其聚集形式会经历“单体-二体-单体-纤维高聚”的变化。而纤维高聚体的形成,会诱导SPARDA复合物的效应核酸酶结构域DREN在纤维表面发生四聚化,而四聚化会激活DREN核酸酶的旁切活性,从而降解宿主细菌内各种形式的核酸,并最终导致细菌的死亡或休眠。该研究清晰地刻画了SPARDA实现对抗噬菌体入侵的分子细节,为相应的核酸检测应用和细菌感染治疗提供了思路。
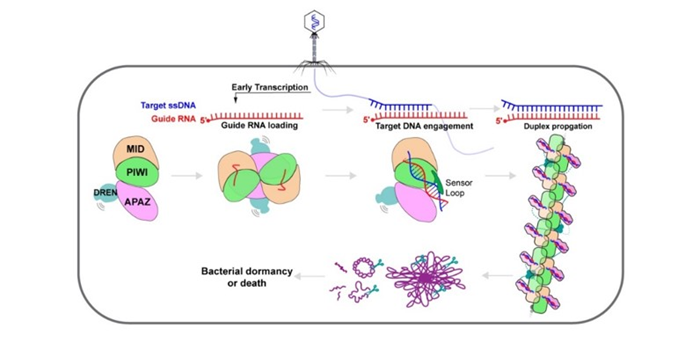
图2 SPARDA细菌免疫系统的工作模式图
李壮团队一直致力于可编程核酸酶的基因挖掘、生化性质、以及工作机理的探究。自2022年成立实验室以来,以通讯作者在Cell Research、Molecular Cell、Nucleic Acids Research、Journal of Molecular Biology等学术期刊多篇研究论文。该研究得到了科技部重点研发计划、国家自然科学基金的支持。
(审稿:黄裕钊)