近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室李珊珊/余希岚团队,在Nature出版集团期刊Cell Discovery发表了题为“Glc7/PP1 dephosphorylates histone H3T11 to regulate autophagy and telomere silencing in response to nutrient availability”的研究论文。该研究阐明了细胞感知胞外营养变化进而调控自噬与端粒结构的新机制,揭示了糖代谢调控细胞衰老的新通路(图1)。硕士研究生张欣宇、博士研究生余奇和吴银盛为本文共同第一作者,李珊珊教授与余希岚教授为本文通讯作者,湖北大学为第一单位。

图1 文章首页
李珊珊/余希岚教授课题组长期致力于研究糖代谢调控衰老过程中的表观遗传机制。2015年,李珊珊教授在酿酒酵母里纯化鉴定出SESAME复合体,该复合体催化组蛋白H3T11发生磷酸化来调控基因表达和增强细胞抵抗氧化应激压力的能力。2021年,李珊珊课题组发现SESAME复合物不仅在常染色体上有结合,在端粒异染色质上也有明显的结合,SESAME通过磷酸化端粒附近的组蛋白H3T11来促进SIR(沉默信息调节蛋白复合物)在端粒的结合,从而维持端粒的异染色质结构。2022年,该课题组发现SESAME催化的H3T11磷酸化通过抑制Dot1催化的H3K79三甲基化来下调自噬和维持端粒异染色质结构。今年3月,该课题组在内皮细胞里发现该机制具有物种保守性,丙酮酸激酶PKM2通过催化H3T11磷酸化延缓细胞衰老。目前,关于H3T11去磷酸化的磷酸酶鲜有报道。
为寻找催化组蛋白H3pT11的磷酸酶,该课题组研究人员通过筛选酿酒酵母中磷酸酶突变体库发现调节糖原代谢的酶Glc7可直接催化H3T11去磷酸化(图2)。进一步研究发现Glc7与H3pT11在基因组上结合模式呈现相反趋势,Glc7催化编码区的组蛋白H3pT11去磷酸化(图2)。
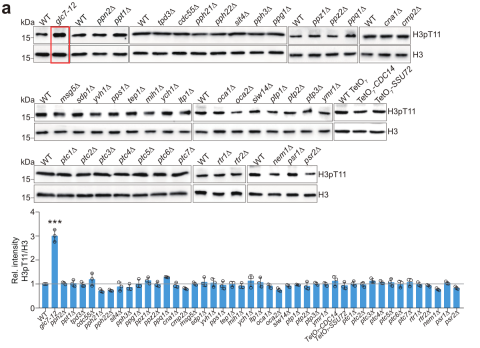
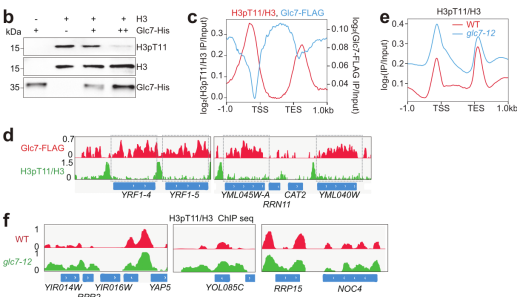
图2 Glc7催化H3pT11去磷酸化
该研究团队通过蛋白质亲和质谱技术发现Glc7可以形成Glc7-Sen1和Glc7-Rif1-Rap1两个复合物。Sen1将Glc7招募至常染色质区域,催化自噬基因上H3T11去磷酸化来激活细胞自噬。Rif1与Rap1将Glc7招募至端粒异染色质区域,催化端粒区域H3T11去磷酸化从而破坏端粒结构(图3)。在营养饥饿条件下,Glc7-Sen1复合物促进自噬介导Sir2蛋白的降解,从而破坏端粒结构。
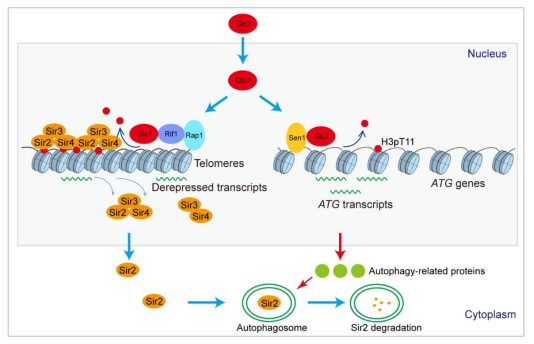
图3 Glc7/PP1催化H3pT11去磷酸化调控细胞自噬和端粒沉默示意图
更重要的是,Glc7-Sen1和Glc7-Rif1两个复合物的组成与功能在哺乳动物里高度保守。一方面,Sen1的同源蛋白SETX将Glc7的同源蛋白PPP1CA招募到自噬基因上,催化自噬基因上组蛋白H3T11去磷酸化,加快细胞自噬。另一方面,Rif1将PPP1CA招募到端粒异染色质区域,催化端粒区域组蛋白H3T11去磷酸化,破坏端粒异染色质结构,缩短端粒长度与加速细胞衰老。
该研究鉴定了Glc7/PP1作为H3T11去磷酸化酶,揭示了Glc7通过形成两种特异性的复合物来调控自噬和端粒异染色质结构,阐明了细胞感应胞外营养变化的新机制,为抗衰老药物开发提供了新靶点。
李珊珊教授和余希岚教授团队一直从事糖代谢调控衰老与肿瘤发生的表观遗传学研究。近年来,以湖北大学为第一单位在Nature Metabolism、Nature Structural & Molecular Biology、Nature Communications (4篇)、Science Advances、Cell Discovery、Nucleic Acids Research (2篇)、Autophagy等国际知名权威期刊上发表30余篇高水平文章,并获得国家自然科学基金、湖北省创新群体、湖北省杰青项目等多项国家级和省部级科研项目的支持。
原文链接:https://www.nature.com/articles/s41421-023-00551-1
(审稿:谢玉平)