近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室李壮课题组在《Molecular Cell》上发表题为《Mechanisms for HNH-mediated target DNA cleavage in type I CRISPR-Cas systems》(I型变体CRISPR-Cas系统通过HNH核酸酶实现靶DNA精准切割的工作机理)的研究论文。该研究发现,crRNA介导的靶DNA定位和靶DNA诱导的HNH构象变化是其精准切割靶DNA的关键因素。研究生张晨滴、陈福根、王凤、徐海江和薛佳琳为该论文的共同第一作者,李壮副教授为该论文的通讯作者。

图1 文章封面
CRISPR-Cas系统广泛存在于细菌和古细菌中,用于抵抗外来核酸的入侵。CRISPR-Cas系统目前可以划分成两大类7种类型,其中I型是原核生物中存在丰度最高的类型,包含多种亚型(I-A到I-G)。I型系统通过形成Cascade复合物,并招募Cas3核酸酶来实现对靶DNA的降解。最新的生物信息学研究发现了两个I型变体系统(此处命名为I-EHNH和I-FHNH),它们都缺乏Cas3核酸酶但却在核心亚基上融合了HNH核酸酶结构域,以实现对靶DNA的切割。这两种系统都可以通过重编程在哺乳动物细胞中产生突变,显示出了巨大的基因组编辑潜力。然而,它们的工作机理一直不清楚。
本研究首先解析了多种状态下的I-EHNH和I-FHNH变体复合物的冷冻电镜结构,发现与常规复合物的整体结构具有较高的相似性。对I-FHNH变体复合物工作机理的进一步研究发现,完整R-loop结构的形成会触发该复合物的构象变化,并造成HNH核酸酶发生巨大的翻转,以实现对靶DNA的精准切割。对I-EHNH变体复合物工作机理的进一步研究发现,crRNA与靶DNA的完整配对会触发该复合物的构象变化,并使得HNH核酸酶和Cas11e形成的底物切割孔道变宽,因此靶DNA得以进入切割位点并被切割。总的来说,本研究通过系统的结构和生化研究,阐明融合了HNH核酸酶结构域的I型CRISPR-Cas变体系统的工作机理,为进一步的基因编辑应用和优化开发做了铺垫。
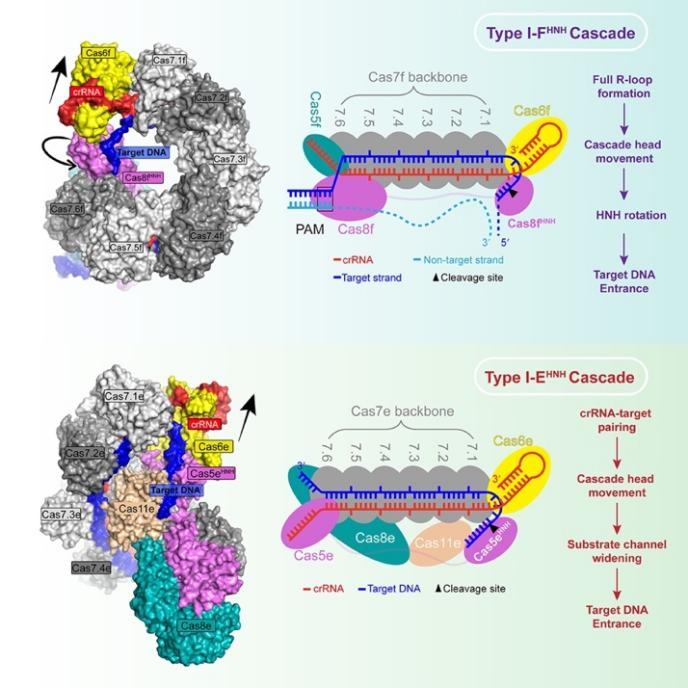
图2 I-FHNH和I-EHNHCascade变体复合物的工作机理示意图
据悉,李壮课题组一直致力于可编程核酸酶的基因挖掘、生化性质、以及工作机理的探究。自2022年成立实验室以来,以通讯作者在Molecular Cell(2篇)、Nucleic Acids Research(2篇)、Cell Research、Nature Communications等学术期刊多篇研究论文。该研究得到了科技部重点研发计划、国家自然科学基金支持。
(审稿:谢玉平)